细胞焦亡是一种新型的非凋亡性程序性细胞死亡(PCD),在肿瘤治疗中具有很高的前景。细胞焦亡过程中释放的大量细胞内容物可以激活免疫系统并引起炎症反应,为增强肿瘤免疫治疗提供了新的机会。迄今为止,焦亡诱导剂大多是从化疗药物进化而来的,如阿霉素和拓扑替康。然而,化疗药物的耐药性和副作用以及无法控制的焦亡诱导方式阻碍了它们在肿瘤治疗中的应用。因此,设计一种更有效、非侵入性的焦亡调节剂以提高肿瘤治疗效率具有重要意义。
声动力治疗(SDT)作为一种非侵入性癌症治疗方法,利用低强度超声而不是光疗法中使用的光作为激发源来激活声敏剂以产生ROS,从而对癌细胞和肿瘤组织造成损伤。除了非侵入性和具有特定的时空选择性外,SDT还可以穿透更深的组织(10-20cm),并能够通过超声激发消融深层肿瘤,这在肿瘤治疗的临床转型中具有潜力。在此背景下,是否存在一种SDT介导的焦亡调节剂来促进肿瘤治疗,它还具有较低的生物毒性、较高的肿瘤特异性和较大的治疗深度,这值得探索。
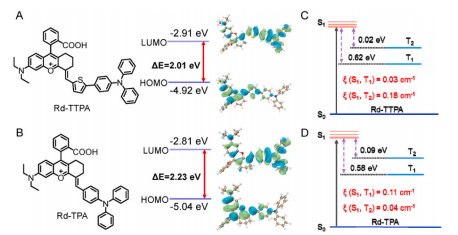
具有适当分子运动基团的强供体(D)-受体(A)型分子通常会减小单线态(S1)和三重态(T1)之间的能隙ΔEST,促进T1态的形成,进而促进ROS的产生。该研究设计了一种新的A-π-D1-D2型分子Rd-TTPA,其具有增强的D-A相互作用和分子内运动,其中罗丹明支架作为电子受体(A)和π共轭体系,噻吩环和三苯胺单元分别作为第一和第二供体(D1,D2),以及可旋转的乙烯基和C-C单键以增加分子内运动。在超声波照射下,Rd-TTPA可以在溶液中有效地产生大量的O2-•,使其能够作为声敏剂。细胞和体内研究证明,Rd-TTPA通过其正电荷主动靶向癌细胞的线粒体,并通过SDT产生的ROS诱导细胞焦亡,通过焦亡增强SDT达到良好的抗肿瘤效果。此外,Rd -TPA还具有优异的NIR-II荧光发射能力(λmax=1000 nm)和较大的斯托克斯位移(340 nm),这更有利于体内精确的肿瘤成像,有助于按需联合治疗。
研究成果发表于国际著名期刊《Biomaterials》上(IF=12.8),题为“A NIR-II Emissive Sonosensitized Biotuner for Pyroptosis-enhanced Sonodynamic Therapy of Hypoxic Tumors”。第一通讯作者为海南大学化学化工学院迟伟杰教授、共同通讯作者为湖北大学毛志强教授和韩国高丽大学Jong Seung Kim教授。
相关研究得到国家自然科学基金项目(32360236)经费资助。
全文连接:https://www.sciencedirect.com/science/article/pii/S0142961224005040
撰稿:迟伟杰
编辑:李诗琪
审核:潘福生

